Ozono y clorofluorocarbonos (CFC)
El mundo ha cambiado ostensiblemente desde que investigadores de las más diversas áreas dieran la señal de alarma ante la debacle ambiental que la actividad descontrolada del hombre estaba creando.
Primero fue la comprobación del hecho de que los ecosistemas estaban siendo seriamente afectados por los desechos industriales, nucleares y domiciliarios y que el uso de combustibles fósiles estaban degradando la calidad de vida de los habitantes de las grandes urbes.
Finalmente, como corolario a todo lo anterior, se descubre que uno de los "pilares" de la comodidad y modernidad de nuestra era, esto es, el uso de refrigerantes, aerosoles, espumas plásticas y sistemas de prevención de incendios, eran los principales causantes de la destrucción de la capa de ozono del planeta.
Definitivamente, después de este anuncio, el mundo ya no podía ser el mismo de antes. Es que la importancia de este, hasta hace poco desconocido ozono, radica en que protege toda la cadena de vida del planeta, ya que su estructura permite absorber los peligrosos rayos ultravioletas (UVB) provenientes del sol.
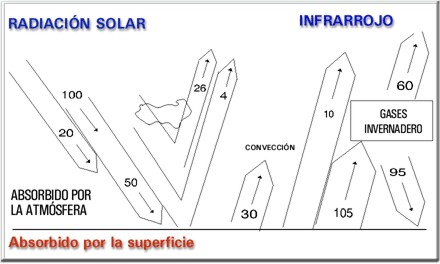
La figura 1 muestra un esquema de balance energético de las radiaciones de luz solar y sus filtros naturales antes de llegar a la superficie de la tierra.
Los elementos que destruyen la capa de ozono
La primera voz de alerta provino de un trabajo publicado en 1974 por los científicos Sh. Rowland y M. Molina de la Universidad de California, quienes pusieron de manifiesto que los clorofluorcarbonos (CFC) usados en refrigeración, aire acondicionado y fabricación de espumas plásticas, eran los responsables de la rápida destrucción de ozono.
Muchos años han pasado y trabajos realizados con posterioridad han confirmado y aportado nuevas evidencias sobre el rol de los átomos cloro y bromo en la secuencia de reacción química que destruye el ozono.
Para resumir, el mecanismo de reacción se puede esquematizar de la siguiente manera:
1) Los CFC y halones (CFBr) son compuestos muy estables (pueden tener una vida media mayor de cien años). Por lo tanto, cuando son liberados a la atmósfera, no son degradados y alcanzan la estratósfera.
2) Es en este lugar donde son irradiados por la luz UV y se descomponen rápidamente para liberar átomos de Cloro (o Bromo), los cuales comienzan una cadena de reacciones fotoquímicas que interfieren con el ozono estratosférico, teniendo como consecuencia la destrucción de este último.
Se estima que un átomo de cloro, antes de ser neutralizado, puede destruir cien mil (100.000) moléculas de ozono.
La figura 2 muestra en forma simplificada el proceso de degradación del ozono.
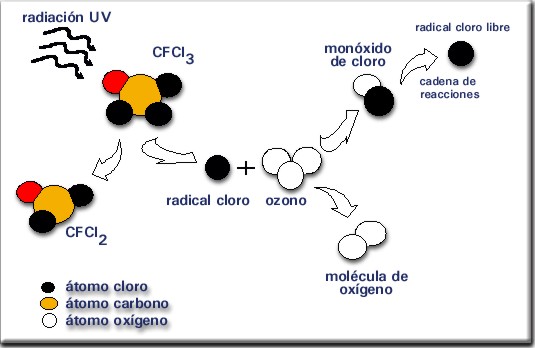
Figura 2:
Efecto de los CFC sobre el ozono estratosférico.
Se han
realizado, en los últimos años, numerosas mediciones de nivel de la columna de ozono
en
la Antártica. La figura 3 muestra los resultados de mediciones de ozono durante la primavera antártica.
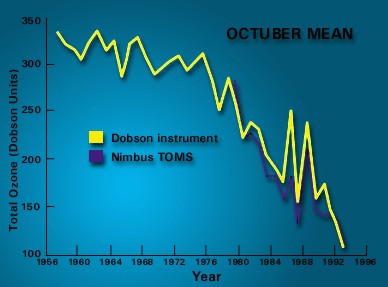
Figura 3:
Diagrama de mediciones de ozono en
la Antártica, promedio de Octubre.
Es importante
recalcar que en todo el planeta se ha venido registrando una disminución
persistente de los niveles existentes al año 1979. Los trabajos científicos
realizados hasta el momento muestran plena coincidencia al atribuir los bajos
niveles de ozono existentes a los cloruros introducidos a la atmósfera.La magnitud del "agujero" de la capa de ozono es prácticamente del tamaño del continente helado.
Otro punto interesante de aclarar a la opinión pública, es que el esfuerzo que hoy día se realiza para frenar la producción de CFC y halones, tendrá sus efectos en el mediano y largo plazo.
En efecto, se calcula que aunque el consumo y producción de estas sustancias se eliminara hoy, posiblemente el restablecimiento de los niveles normales de ozono tomaría a lo menos un par de décadas, esto debido a que la estabilidad molecular y el período de vida media de los CFCs y halones son extremadamente altos.
En la figura 4 se pueden observar los promedios de vida en la atmósfera de CFCs y HCFC comunes.
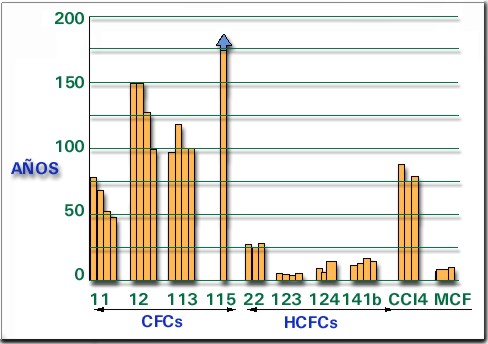
Figura 4:
Períodos de vida media de Clorofluorcarbonos en la
atmósfera. El eje horizontal corresponde al tipo de compuesto representado.
Clorofluorocarburos (CFC o ClFC)
Los clorofluorocarburos (CFC o ClFC) son derivados de los hidrocarburos saturados obtenidos mediante la sustitución de átomos de hidrógeno por átomos de flúor y/o cloro principalmente.Los CFC son una familia de gases que se emplean en diversas aplicaciones, principalmente en la industria de la refrigeración y de propelentes de aerosoles. Están también presentes en aislantes térmicos. Los CFC tienen una gran persistencia en la atmósfera, de 50 a 100 años. Con el paso del tiempo alcanzan la estratosfera, donde se disocian por acción de la radiación ultravioleta, liberando el cloro y dando comienzo al proceso de destrucción de la capa ozono. CFC es el nombre genérico de un grupo de compuestos que contienen cloro, flúor y carbono, utilizados como agentes que producen frío y como gases propulsores en los aerosoles. Sus múltiples aplicaciones, su volatilidad y su estabilidad química provocan su acumulación en la alta atmósfera, donde su presencia, según algunos científicos, es causante de la destrucción de la capa protectora de ozono.

Moléculas de CFC obtenidas por la sustitución de átomos de hidrógeno por átomos de flúor o cloro
Usos y propiedades
Son usados principalmente con fin industrial, tanto para la formación de aerosoles como para la creación de refrigerantes además de otros artículos, tanto de uso personal como industrial e informático. Los clorofluorocarburos (CFC o ClFC) son derivados de los hidrocarburos saturados obtenidos mediante la sustitución de átomos de hidrógeno por átomos de flúor y/o cloro principalmente.Los C.F.C. o C.F.C son una familia de gases que se emplean en múltiples aplicaciones, principalmente en la industria de la refrigeración y de propelentes de aerosoles. Están también presentes en aislantes térmicos. Los CFC tienen una gran persistencia en la atmósfera, de 50 a 100 años. Con el correr de los años alcanzan la estratósfera, donde se disocian por acción de la radiación ultravioleta, liberando el cloro y dando comienzo al proceso de destrucción del ozono. Nombre genérico de un grupo de compuestos que contienen cloro, flúor y carbono, utilizados como agentes que producen frío y como gases propulsores en los aerosoles. Se conoce también con la sigla CFC; sus múltiples aplicaciones, su volatilidad y su estabilidad química provocan su acumulación en la alta atmósfera, donde su presencia, según algunos científicos, es causante de la destrucción de la capa protectora de ozono.

Tipos de CFC según su comercialización
- El CFC-12 es un gas a temperatura ambiente. Hasta hace poco, se utilizó extensamente en acondicionadores de aire de automóviles, de donde eran liberados a la atmósfera durante su uso y servicio. Actualmente se utiliza un equipo especial para capturar los CFC (y sus modernos sustitutos) cuando los acondicionadores de aire de los coches han finalizado su servicio.
- El compuesto CFCl3, llamado CFC-11, es un líquido que hierve a temperatura cercana a la ambiental. El CFC-11 se utilizó para formar agujeros en productos de espuma blanda, como almohadas, alfombras acolchadas, cojines y asientos y rellenos en coches. Este compuesto también ha sido aplicado para hacer productos de espumas de uretano rígido usados como aislantes en neveras, congeladores y en algunos edificios. La utilización de productos de espumas aislantes aumentó en el último cuarto de siglo debido al interés con respecto a la conservación de energía.
- El otro CFC que origina gran preocupación ambiental es el CF2Cl--CFCl2, llamado CFC-113. Este compuesto ha sido utilizado ampliamente para limpiar la grasa, el pegamento y los residuos de soldadura en paneles de circuito electrónicos después de su fabricación, cosumiendose cerca de 2 kilogramos por metro cuadrado. Muchos fabricantes han cambiado sus procesos de fabricación con el fin de no utilizar ningún tipo de líquido de limpieza. Los CFC no poseen ningún sumidero troposférico de tal manera que todas sus moléculas ascienden a la estratosfera. Este proceso de transporte vertical en la atmósfera no está afectado por el hecho de que la masa de éstas moléculas sean mayor que la masa promedio del Nitrógeno y del Oxígeno en le aire, ya que la fuerza diferencial de gravedad es mucho menor que la debida a la de las constantes colisiones de otras moléculas que aleatorizan las direcciones de moléculas, incluso las pasadas. Mediante este transporte, las moléculas de CFC, finalmente, migran a las partes medias y altas de la estratosfera donde hay suficiente UV-C de la luz solar aún no filtrada para descomponer fotoquímicamente dichas moléculas, liberando de este modo átomos de cloro.
- El tetracloruro de carbono, CCl4, es una sustancia disminuidora de ozono (SDO). Comercialmente, se ha utilizado como disolvente y como intermedio en la fabricación de CFC-11 y CFC-12, perdiéndose cierta cantidad hacia la atmósfera durante su producción. Su aplicación como disolvente en la limpieza en seco ha sido interrumpido en la mayor parte de los países desarrollados, aunque hasta muy recientemente su práctica aún continuaba en muchos otros países.
- El metilcloroformo, CH3--CCL3, o 1,1,1- tricloroetano, fue producido en grandes cantidades y utilizado en la limpieza de metales, de tal manera que una gran parte se liberó a la atmósfera. Aunque, cerca de la mitad de esta cantidad ha sido eliminada de la troposfera por reacción con el radical hidroxilo, el resto sobrevive suficiente tiempo como para migrar hacia la estratosfera. En la actualidad el metilcloroformo y el tetracloruro de carbono contribuyen, conjuntamente, en cerca de la mitad de la contribución de los CFC al cloro de la estratosfera.
-
Degradación del ozono
Se ha propuesto que el mecanismo a través del cual los CFC atacan la capa de ozono es una reacción fotoquímica: al incidir la luz sobre la molécula de CFC, se libera un átomo de cloro con un electrón libre, denominado radical cloro, muy reactivo y con gran afinidad por el ozono, que rompe la molécula de este último. La reacción sería catalítica; la teoría propuesta estima que un solo átomo de cloro destruiría hasta 100.000 moléculas de ozono. Algunos alegan que CFC permanece durante más de cien años en las capas altas de la atmósfera, donde se encuentra el ozono, pero esto es imposible dado que las moléculas de CFC tienen un peso molecular que varía entre 121,1 y 137,51 mientras que la densidad de la atmósfera es 29.01, por lo que las escasas moléculas de Freones que llegan hasta la estratósfera caen en poco tiempo de regreso hacia tierra.Los estudios de Fatbian, Borders y Penkett (ref: P.Fabian, R. Borders, S.A. Penkett, et al., “Halocarbons in the Stratosphere.” Nature, (Dec. 24) pp. 733-735) demostraron que los Freones F-11 y F-12 alcanzaban un máximo de 29 a 32 km de altura, en donde sus concentraciones varían entre 0,1 a 10 ppb (partes de billón). Considerando que la energía necesaria para que la radiación UV disocie a la molécula de CFC tiene que ser igual o mayor que la de la banda UV-C (286-40 nanómetros), y esta radiación es totalmente absorbida por el oxígeno más arriba de los 45 km de altura, la radiación necesaria para disociar a los CFC no llega hasta la altura donde se encuentran las primeras moléculas.
En 1987 se firmó un acuerdo internacional, el Protocolo de Montreal relativo a las sustancias destructoras de la capa de ozono”, para controlar la producción y el consumo de sustancias que destruyen el ozono. En este protocolo se estableció el año 1996 como fecha límite para abandonar totalmente la producción y el consumo de clorofluorocarburos en los países desarrollados. Los países en vías de desarrollo disponen de 10 años más para el cumplimiento de este requisito. También se establecieron controles para los haluros, el tetracloruro de carbono, el 1,1,1-tricloroetano (metil cloroformo), los hidroclorofluorocarburos (HCFC), los hidrobromofluorocarburos (HBFC) y el bromuro metílico. Estos productos químicos sólo se permiten para usos esenciales y siempre que no existan alternativas técnica y económicamente viables.3
Por añadidura, la eficacia de la destrucción del ozono aumenta si están presentes nubes estratosféricas. Esto sucede sólo en el frío de la noche polar, cuando las temperaturas descienden a menos de 200 K y, en el Antártico, a 180 K o menos. En la primavera antártica, fundamentalmente en octubre y noviembre, se han registrado cantidades de ozono notablemente reducidas y menguantes desde 1975. Este fenómeno se conoce como el agujero de ozono. Cuando el sol regresa, la pérdida se recupera rápidamente.
CAPA DE OZONO
- Capa de ozono y ozono. Conceptos:
La capa de ozono se encuentra en la estratosfera, aproximadamente de 15 a 50 Km. sobre la superficie del planeta. Se considera un delgado escudo de gas, que rodea a la Tierra y la protege de los peligrosos rayos del sol.
El ozono es un compuesto inestable de tres átomos de oxígeno, el cual actúa como un potente filtro solar evitando el paso de una pequeña parte de la radiación ultravioleta (UV) llamada B que se extiende desde los 280 hasta los 320 manómetros (nm). Se descompone en presencia de Cloro y oxida a la mayor parte de los metales. Es más estable a altas temperaturas, y es muy peligroso ya que en ciertas concentraciones es violentamente explosivo. Es más pesado y activo que el oxígeno. También es más oxidante, razón por la cual se lo utiliza como desinfectante y germicida
El ozono se produce mediante el efecto de la luz solar sobre el oxígeno y es la única sustancia en la atmósfera que puede absorber la dañina radiación ultravioleta (UV-B) proveniente del sol. Este delgado escudo, ozono estratosférico, hace posible la vida en la tierra.
Desde 1974, los científicos han advertido acerca de una potencial crisis global como resultado de la progresiva destrucción de la capa de ozono causada por sustancias químicas hechas por el hombre, tales como los clorofluorocarbonos (CFCs). El contenido total de ozono en la atmósfera se define a partir de la cantidad de ese gas, contenida en una columna vertical de 1 cm2 de base, a valores de presión y temperatura. Puede ser expresada en unidades de presión.
Un valor más frecuente es el que se expresa en miliatmosferas/centímetros, lo que define a la UNIDAD DOBSON (UD). Una UD corresponde, en promedio, a una concentración aproximada a una parte por billón en volumen. Los valores usuales observados en la atmósfera oscilan entre los 230 y 500 UD.
El ozono lo podemos encontrar de dos maneras:
1. El ozono formado en la atmósfera (desde la superficie de la tierra hasta 15 kilómetros de altura), es muy nocivo para los seres vivos, pues además de ser un contaminante, participa en el efecto invernadero. En este caso es un contaminante que es llamado secundario porque no se emite directamente a la atmósfera, sino que se forma en el aire cuando los hidrocarburos y los óxidos de nitrógeno reaccionan bajo la luz del sol generalmente en los días tibios y soleados con temperaturas que oscilen entre los 24° y 32°C. En los últimos años los niveles de ozono han aumentado considerablemente.
2. Por otro lado, forma parte de las capas superiores de la atmósfera (lo encontramos en la estratosfera unos 25 kilómetros de altura) y funciona como un compuesto vital, ya que ayuda a filtrar los rayos ultravioleta provenientes del sol y evita que el 90% de la radiación solar ultravioleta atraviese la atmósfera y cause algún daño en las cosechas o en las células de los organismos vivos, ya que puede provocar cáncer en la piel.
- Agujero de ozono. Concepto:
Aunque no se trata en realidad de un agujero, sino de un adelgazamiento de la capa de ozono que envuelve todo el planeta y que tiene la virtud de filtrar las radiaciones ultravioletas. Esa disminución se produce con mayor énfasis sobre el extremo sur de la tierra, y genera que las radiaciones lleguen con más poder hasta la superficie terrestre, causando así alteraciones biológicas. El agujero en la capa de ozono se ha ido generando por el debilitamiento de la concentración del ozono en la estratosfera, el cual provoca un adelgazamiento en una región tan grande como Alaska, localizándose fundamentalmente sobre la Antártica, siendo Tierra del Fuego -en la Argentina- la ciudad que sufre las agresiones del sol de forma más directa.
El agujero de ozono tiene forma ovalada y su centro está ubicado a unos 900 kilómetros del polo sur. Este fenómeno alcanza sus dimensiones máximas entre septiembre y diciembre. Los estudiosos aseguran que sus extensiones máximas rondan los 24 millones de kilómetros cuadrados, pero ha llegado a 27 millones.
¿Qué son los CFC´s?

Los clorofluorocarbonos (CFC) son una familia de compuestos formados por átomos de Carbono, Flúor y Cloro.
Estos compuestos no son tóxicos, ni inflamables y tienen una reactividad muy baja. Además tienen unas propiedades físicas que los hacen muy eficaces como refrigerantes. Por todas estas características, los CFC son unos compuestos muy útiles comercialmente; con extensas aplicaciones
como refrigerantes, gases propelentes en sprays y en espumas,
aislantes, etc., e incluso como limpiadores por sus propiedades
disolventes.
Durante la década de 1980 se liberaron a la atmósfera más de 1 millón de toneladas por año, sin considerar los efectos adversos que esto podría producir.
Más tarde se observó una relación directa entre las emisiones de CFC a la atmósfera y el tamaño del agujero de ozono cada temporada. Esto se debe a la baja reactividad de los CFC, que permite que lleguen inalterados a la estratosfera. Una vez allí la radiación UV los fotoliza, liberando radicales de cloro. Estos radicales de cloro intervienen en una serie de reacciones químicas cuyo resultado es la destrucción de las moléculas de ozono (O3), con la consiguiente disminución del espesor de la capa de ozono estratosférica. Además, se estima que un sólo radical de cloro es capaz de destruir unas 50 mil moléculas de ozono.
Afortunadamente, se firmaron acuerdos internacionales
como el Protocolo de Montreal (1987), al que siguieron el de Londres
(1990), Copenhague (1992), Viena (1995) y Montreal (1997), con el fin de
limitar las emisiones de estos compuestos a la atmósfera.
Toda la producción legal de estos compuestos finalizó
en 1995 en todos los países industrializados y los países en vías de
desarrollo deberán hacer lo mismo durante el presente año 2010.
- Consecuencias:
- Posibles soluciones:
FUENTES DE CONSULTA:
http://es.wikipedia.org/wiki/CFC
http://cuidemos-el-planeta.blogspot.com/2010/12/que-son-los-cfcs.html
http://www.profesorenlinea.cl/Quimica/Ozono_y_CFC.htm
http://html.rincondelvago.com/capa-de-ozono_9.html
NOMBRE: ANGIE YÉPEZ
CURSO: 1ERO "K"
FECHA: 2015-05-26

No hay comentarios:
Publicar un comentario